Nephrin抗体作为足细胞肾病的一种新型循环渗透因子,被认为在区分免疫因素与非免疫因素相关的MCD(微小病变型肾病)/FSGS(局灶节段性肾小球硬化)方面具有重要价值。然而,目前在Nephrin抗体的检测与定量方面存在诸多挑战。人体血清包含上万种蛋白和抗体,而Nephrin抗体含量极低,易受高丰度蛋白干扰,且易与血清中其他杂质结合,导致假阴性结果。
国际上各Nephrin检测团队已报告多种检测Nephrin抗体的策略,包括利用重组人肾小球基底膜进行免疫沉淀(图1A) 、结合信号增强的ELISA与重组人肾小球基底膜(图1B,左)、采用传统 ELISA,以及免疫沉淀结合ELISA法对沉淀的重组肾小球基底膜进行定量的联合方法(图1B,右)等。
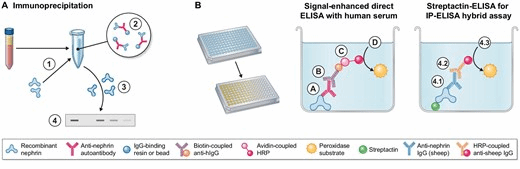
图1:Nephrin抗体的检测。(A) 人类血清样本中Nephrin抗体检测的免疫沉淀概述。(1) 人类血清与重组肾小球基底膜蛋白孵育以形成抗体-抗原复合物。(2) 加入抗体结合树脂或珠以沉淀抗体-抗原复合物。(3) 沉淀的蛋白质经洗脱释放抗体和结合抗原。(4) 凝胶电泳和 western blotting 可用于在沉淀了重组蛋白的样本中特异性检测沉淀的肾小球基底膜蛋白。(B)不同ELISA技术在检测人类血清样本中Nephrin抗体的概述。(左)信号增强的直接ELISA使用固定化的重组肾小球基底膜,人类抗体与其结合 (A),并通过生物素连接的抗人类免疫球蛋白G (IgG) 抗体检测 (B)。然后通过抗生物素蛋白连接的辣根过氧化物酶与其结合 (C)。辣根过氧化物酶催化一种显色底物的转化,指示结合的人类抗体的量 (D)。(右)免疫沉淀后进行ELISA的杂交检测法,通过其抗生蛋白标签与streptactin-ELISA板结合,并使用商业化的绵羊来源的Nephrin抗体特异性检测结合的肾小球基底膜 (4.1) 紧接着是与辣根过氧化物酶偶联的 secondary 抗绵羊 IgG 抗体的结合 (4.2),其通过显色底物 (4.3) 进行定量。
近期,德国Hengel团队在《CKJ》期刊上发表综述,深入分析了不同Nephrin抗体检测方法对临床研究结果的影响(表 1)。
表 1:检测方法概述及不同研究和队列中循环Nephrin抗体的检出率
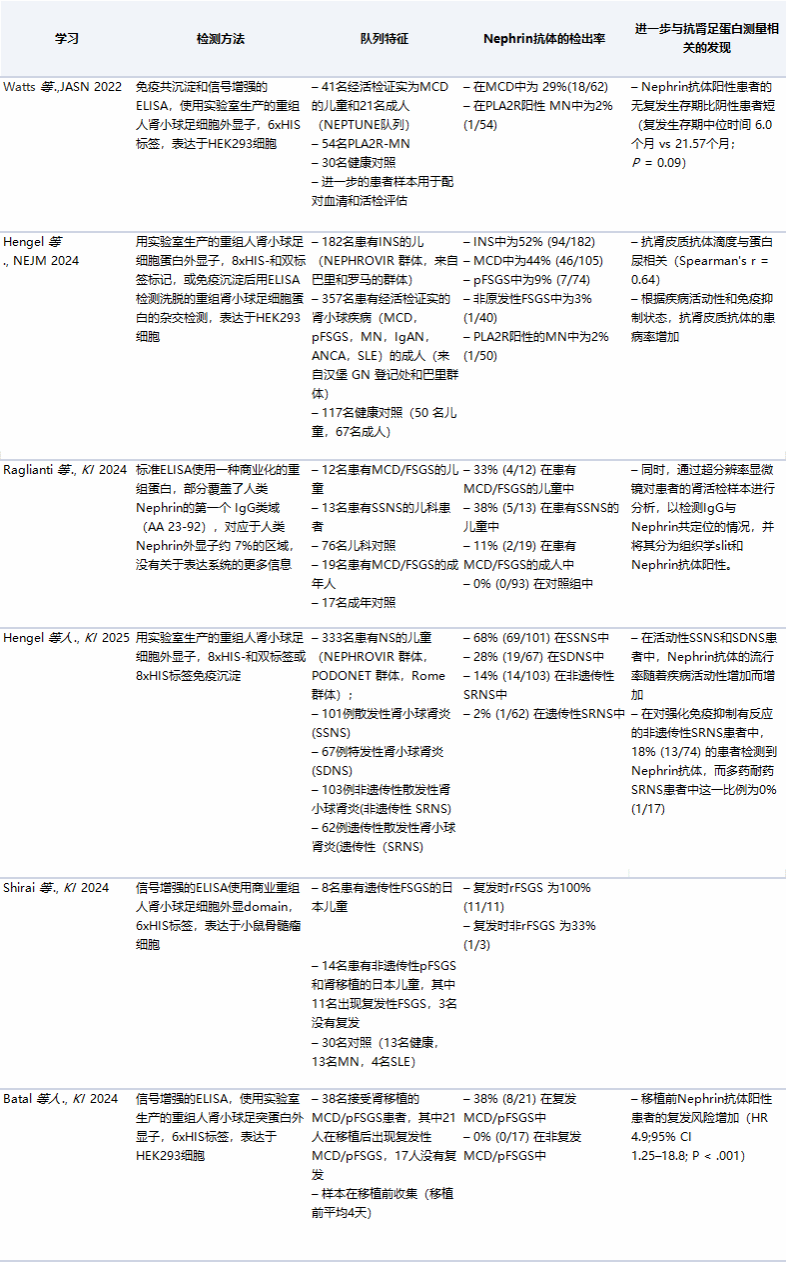
JASN, 美国肾脏病学会杂志; NEJM, 新英格兰医学杂志; KI, 肾脏国际; HEK293, 人胚胎肾细胞293; MN, 膜性肾病; pFSGS, 原发性FSGS; IgAN, IgA肾病; ANCA, 抗中性粒细胞胞质抗体; SLE, 系统性红斑狼疮; SSNS, 类固醇敏感性肾病综合征; SDNS, 类固醇依赖性肾病综合征; HR, 风险比; CI, 置信区间。
Hengel团队还对目前已有报道的Nephrin检测方法的优缺点进行了详细对比分析:
一、免疫共沉淀法(Co-IP)
相较于传统抗体检测方法,展现出显著优势:(1)高灵敏度,通过抗体结合树脂/珠富集和纯化患者抗体,能够有效检测低水平循环自身抗体;(2)高特异性,阳性结果需两个独立抗体 - 抗原复合物形成(血清自身抗体结合溶液中靶抗原,且靶抗原特异性抗体检测沉淀抗原),尽管理论上抗原结合树脂可能存在风险,但可通过适当程序加以控制,并且结合Western Blot检测可进一步利用抗原分子量信息提升特异性,减少假阳性;(3)能够检测弱相互作用,在天然条件下(无变性剂/还原剂或抗原固定)形成抗原-自身抗体复合物,避免了因Western样品制备或ELISA等过程导致的表位结合减少或丧失。这些特点使得Co-IP在检测自身抗体,尤其是低水平抗体方面表现出色。然而,其也存在一些局限性,如高样品需求(例如30µL/ 检测)、操作繁琐且耗时较长,以及仅能通过Western Blot进行半定量。
二、标准 ELISA
标准ELISA(如使用重组肾小球因子包被)具有操作简便、通量高、样品需求低(通常1-2µL/检测)且可通过标准曲线定量抗体等优点。但多项研究显示,标准ELISA未能可靠定量Nephrin抗体,可能是因为Nephrin抗体含量过低,需额外信号放大步骤,而信号放大可能增加非特异性信号,进而导致假阳性结果。
三、免疫共沉淀结合ELISA法
免疫共沉淀结合ELISA法通过对沉淀的重组Nephrin进行定量(图 1B,右),可在一定程度上克服两种方法的缺陷,实现对Nephrin滴度的敏感和特异性定量测量。不过,这种方法仍需大量手工操作,且对样本量的要求比标准ELISA法更高。
四、其他有关Nephrin抗体的检测方法
其他有关Nephrin抗体的检测方法也存在诸多缺陷:一是使用商业化重组肾小球足蛋白或不同的蛋白质标签,由于其与人类表达的肾小球足蛋白不同,或表达系统信息缺乏,导致高假阳性结果;二是对冷冻肾活检标本进行IgG和肾小球基膜的共染色及共定位,这种技术仅通过共定位提示一个可能的抗原,并未明确指出IgG的目标抗原是肾小球基膜;三是基于细胞的荧光技术,虽然可以模拟Nephrin抗体在细胞膜附近结合的条件,但与肾小球滤过屏障的原生裂孔处的局部条件仍存在较大差异。
综合来看,基于抗体捕获和富集路径的Nephrin抗体检测方法,可以提升Nephrin抗体检测的稳定性和可重复性,从而在诊断、预后和治疗指导方面带来潜在益处。由本中心合作单位奥根诊断研发的Super Nephrin Antibody Trap(SuperNAT)二代高灵敏Nephrin抗体检测方案,基于SuperNAT技术的抗体富集平台,显著降低Nephrin抗体检测的背景噪音,比传统ELISA法检出率提高了53%。