在供体来源游离DNA(ddcfDNA)检测与穿刺病理的配对研究中,已证明ddcfDNA可以诊断排斥反应。随着研究深入,临床开始进一步探索ddcfDNA检测值与Banff诊断指标的相关性。此次ATC会议共有6篇代表性研究聚焦于此方向,接下来我们详细解读。
First Research:Banff病理指标g、ptc、t、i、C4d等评分高低与ddcfDNA是否具有相关性?
已有的单中心小规模研究显示,ddcfDNA可以较特异性地诊断排斥反应。巴黎器官移植转化研究中心(Paris Translational Center for Organ Transplantation, Paris, France)的O. Aubert教授团队在更大规模样本上(1210个穿刺活检样本)验证了这一点,并对ddcfDNA检测值与Banff指标g、ptc、t、i、C4d和cg评分相关性进行了分析。该研究回顾性入组了992例肾移植患者,对其病理活检结果、HLA-DSA和肾功能指标同时评估。共有1210个病理活检结果和配对的ddcfDNA检测结果,分为训练集(N=637)和验证集(N=573)队列。在训练集队列中,包括100个AMR、14个TCMR和7个混合排斥反应(Banff 2019)。使用逻辑回归分析ddcfDNA单变量和包括ddcfDNA、DSA等在内的多重变量与排斥反应的关联,并使用独立关联的变量建立一个排斥风险诊断模型,进一步使用该模型在验证集队列中进行验证。结果显示,与其他类型移植肾损伤病理相比,AMR和/或TCMR中的ddcfDNA检测值显著较高(图1A)。
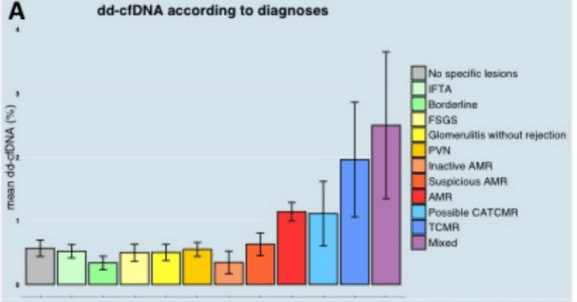 (图1A)
(图1A)
进一步分析显示,ddcfDNA检测值与Banff标准的急性病变指标呈线性相关,但与慢性病变指标无线性关联(图1B)。
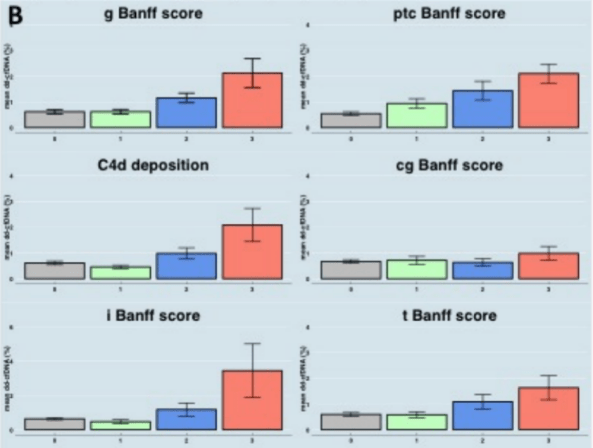 (图1B)
(图1B)
在多重变量逻辑回归分析中,与排斥反应独立相关的变量(或因素)为HLA-DSA(p<0.0001)、ddcfDNA(p<0.0001)、eGFR(p=0.018)、近期排斥史(p<0.0001)和肾功能指标不稳定 (p=0.013)。风险模型显示,不含ddcfDNA变量的受试者工作特征曲线(ROC)的曲线下面积(AUC)为0.769,含ddcfDNA变量的AUC提高到0.827;在验证集队列中,不含ddcfDNA变量的AUC为0.786,含ddcfDNA变量的AUC提高至0.824。该研究认为:ddcfDNA在肾移植排斥诊断中可以作为独立相关风险变量。且该风险模型是首个可提高患者术后监测的综合系统(integrative system),有助于临床医生决策。
Second Research:ddcfDNA在C4d阳性ABMR与C4d阴性ABMR中的差异是什么?
ddcfDNA检测可以弥补肌酐的滞后性以及传统组织病理学诊断的多变性(不同病理医生阅片和不同穿刺点的差异)。德克萨斯大学加尔维斯顿医学分部(Internal Medicine,Nephrology,University of Texas Medical Branch,Galveston)的研究者通过使用ddcfDNA和MMDx检测对ABMR诊疗进行监测,并把ABMR分类为C4d阳性(C+)和C4d阴性(C-)进行比较,进一步评估ddcfDNA在两组间的差异。研究入组了50例ABMR患者,根据组织病理染色分为C4d阳性ABMR组(C+ABMR,16例)和C4d阴性ABMR组(C-ABMR,34例)。分别在穿刺前、穿刺后及治疗后,对其SCr、ddcfDNA和DSA指标进行检测。对C+ABMR组给予IV免疫球蛋白(IVIG)/血浆置换+/-硼替佐米治疗,对C-ABMR组给予IVIG治疗,治疗后两组的维持免疫抑制剂量都相应增加。结果显示,C+ABMR组50%患者和C-ABMR组52%患者呈DSA阳性。两组的ddcfDNA检测值在治疗后都明显下降,而肌酐无明显变化(图2)。另外,当以MMDx检测结果为金标准分析时,C-ABMR组有55%患者结果为ABMR阴性,而在C+ABMR组81%患者结果为ABMR阳性。
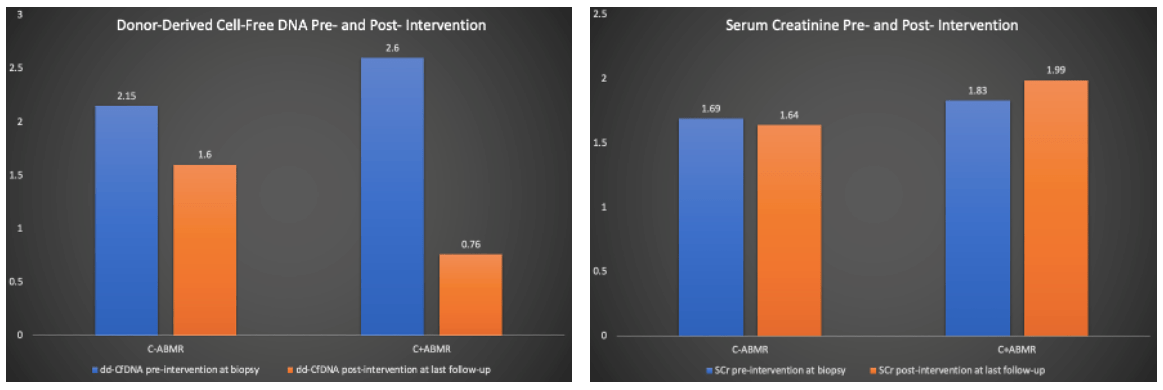 (图2)
(图2)
该研究表明,在ABMR诊断和治疗后的监测流程中加入ddcfDNA检测,在传统病理活检流程中加入MMDx检测方案,有助于对ABMR患者早期识别、及时干预和个体化治疗。
Third~Fifth Research:目前临床对治疗临界性TCMR(boardline TCMR, BL-TCMR)还存在争议,在ddcfDNA结果与病理诊断不一致的病例上,ddcfDNA检测值是否有新的提示参考价值?
加拿大艾伯塔省移植应用基因组学中心(Alberta Transplant Applied Genomics Centre, Edmonton, AB, Canada)的P. F. Halloran教授团队分析了传统组织学活检诊断为BL-TCMR的患者,其ddcfDNA值与分子病理(MMDx)的特征。该研究共收集了426例病理活检样本,分为BL-TCMR组(46例),稳定组(56例)和急性肾损伤组(AKI,23例);通过MMDx检测发现BL-TCMR组达到排斥的只有2例:1例ABMR,1例possible-TCMR,其余44例都不符合MMDx的排斥反应标准。对BL-TCMR组、AKI组和正常组的ddcfDNA和MMDx检测结果进一步研究发现,AKI组肾穿刺时间显著早于BL-TCMR组和正常组,而BL-TCMR组和正常组的穿刺时间无统计学差异(平均值、中位值和范围)。ddcfDNA值在AKI组、BL-TCMR组和正常组间呈梯度递减,与损伤相关基因转录表达评分一致。而排斥反应相关基因转录表达,在三组间无显著统计学差异(图3)。
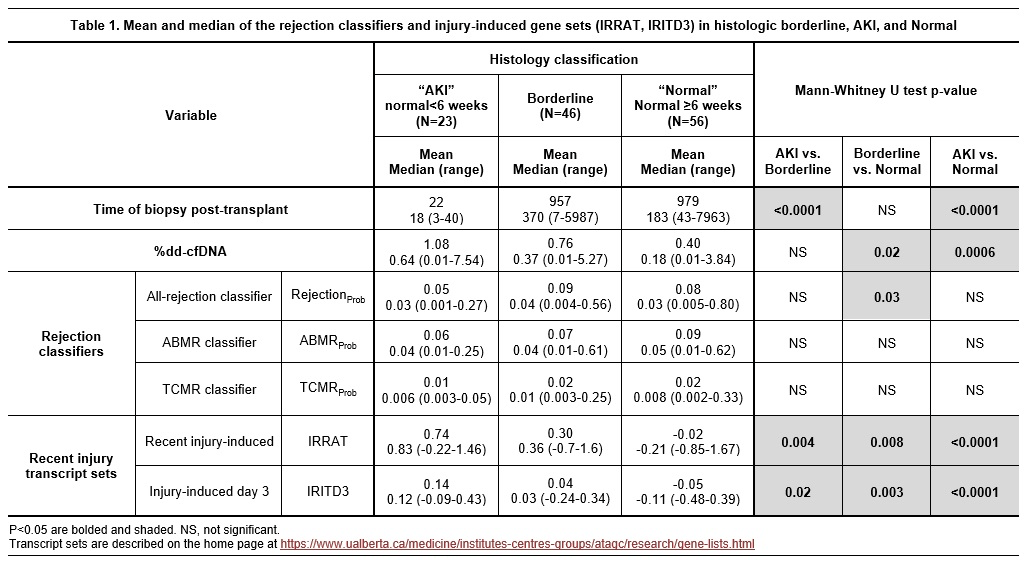 (图3)
(图3)
该研究表明,组织学的临界改变(BL-TCMR)主要与轻微分子损伤而不是排斥反应有关。其ddcfDNA值轻微升高,可能是实质损伤(parenchymal injury)的后期结果。因此,组织学临界改变可能是早期AKI的延续性损伤,不应视为排斥反应。
对于BL-TCMR Banff病理的肾小管炎(t0,t1,t2和t3)与肾间质炎(i0,i1,i2和i3)的不同组合,能否利用ddcfDNA检测值对同一组合(Banff病理诊断相同)的患者,进行区分、分层分类?
杜克大学(Duke University, Durham, NC)的M. J. Ellis教授团队对此进行了研究。该研究回顾性分析了病理活检诊断为BL-TCMR的患者中,其ddcfDNA检测水平与肾小管炎和肾间质炎的相关性。共入组了56例有病理活检结果(BL-TCMR,Banff 2019)、并在穿刺后30天内有ddcfDNA配对检测结果的患者。结果显示,56例患者ddcfDN中位值为0.34%(IQR:0.17-1.00)。其中3例评分t3/i1 (ddcfDNA%:0.04%,4.85%,9.06%),1例评分t1/i3(ddcfDNA%:3.03%),两种评分的入组患者数量较少。进一步把BL-TCMR的病理评分分为五组(t1/i1,t2/i1,t3/i1,t1/i2和t1/i3),发现ddcfDNA值未有显著性差异。活检结果诊断为BL-TCMR的患者与活检诊断非BL-TCMR(孤立性肾小管炎:t1/i0,t2/i0或孤立间质性炎症:t0/i1)患者的ddcfDNA值也未有显著性差异(图4)。进一步分析发现,56例中有31例在指征性活检前63天(IQR:53.5-100)也进行了ddcfDNA检测,中位值为0.24%(IQR:0.20-0.37),两次检测结果相比,后一次的ddcfDNA检测中位值增加了55%(IQR:-9 - 235%)。
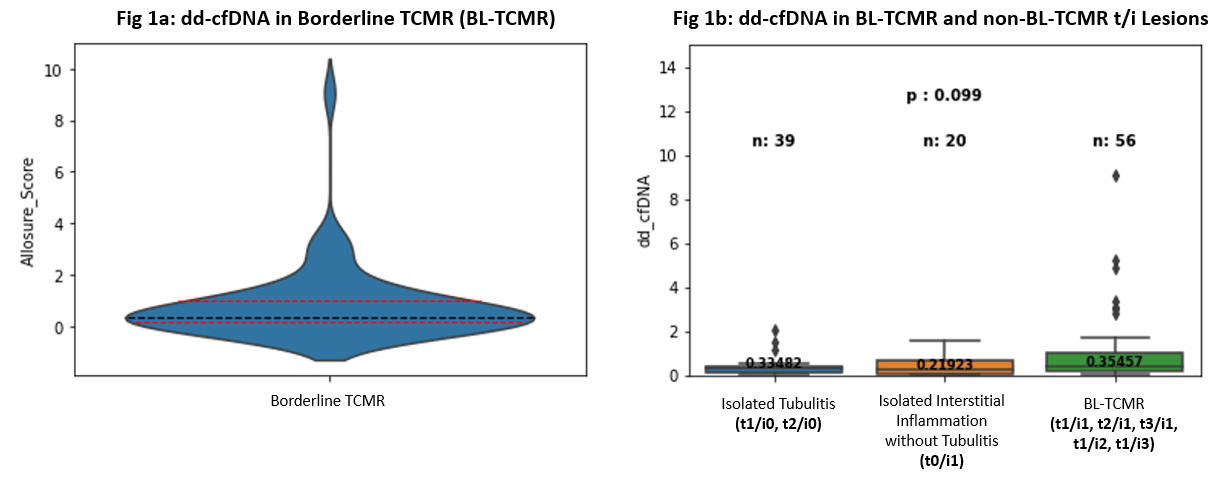 (图4)
(图4)
该研究显示,BL-TCMR Banff病理表现相似,而ddcfDNA值有很大差异(ddcfDNA%:0.04%,4.85%,9.06% VS ddcfDNA%:3.03%)。而ddcfDNA值在BL-TCMR组、孤立性小管炎组和孤立性间质炎组间无显著差异。因此,表明BL-TCMR、孤立性小管炎和孤立性间质炎代表了一系列分子损伤(a spectrum of molecular injury),提示可以通过ddcfDNA值对它们进行风险分层。
对于TCMR(包括BL-TCMR)的风险分层,美国弗吉尼亚联邦大学(Virginia Commonwealth University, Richmond, VA)的D. Kumar教授团队进一步结合了MMDx和ddcfDNA检测,尝试进行分类。对比P. F. Halloran教授团队的研究,D. Kumar教授团队的研究入组了18例传统穿刺病理(H)和MMDx(M)都诊断(H+M+)为BL-TCMR的患者,并对照H+M-组进行分析。该TCMR队列共入组37例患者,其中H+M+ 18例,H+M- 19例,排除患有病毒/细菌性肾炎或混合排斥反应的患者,选择在TCMR治疗前检测ddcfDNA。 结果显示,相比于H+M+组,H+M-组中位ddcfDNA值显著降低(p = 0.02)(0.32%;IQR: 0.15-0.43),在肾间质炎和小管炎(i+t)评分较高时表现更明显(4.8±1.5 vs 3.3±1.2,p=0.002)。对于H+M+组而言,“i+t”的评分和ddcfDNA值之间存在线性相关性,而对于H+M-组,“i+t”的评分和ddcfDNA值之间并无线性相关(图5)。
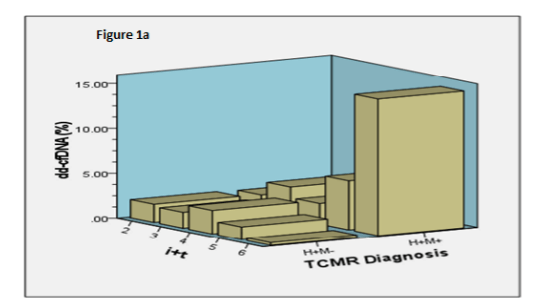 (图5)
(图5)
另外,与H+M-组(40±23ml/min/1.73 m2)相比,H+M+组(27±19ml/min/1.73 m2)在穿刺后3个月及更长时间里,eGFR功能表现更差(p=0.06)(图6)。在治疗方面,89% H+M+患者都接受了排斥治疗(16/18;仅限14种rATG和2种类固醇),而只有37% H+M-患者接受了排斥治疗(7/19)。即使H+M-组没有全部接受排斥治疗,但在之后中位随访14.7个月时,两组eGFR都有显著改善:在H+M+组升高至34±24ml/min/1.73m2,在H+M-组升高至49±26ml/min/1.73m2,且3个月后H+M-组比H+M+组eGFR上升趋势更明显。
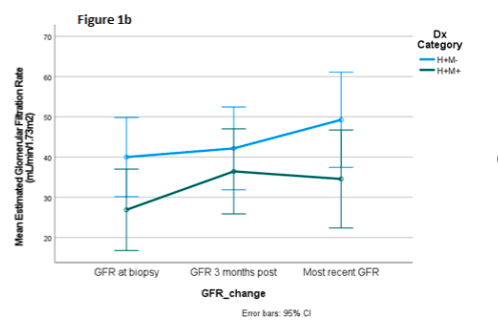 (图6)
(图6)
该研究显示,对于分子病理阴性(M-)而传统病理活检阳性(H+)的TCMR患者,一般ddcfDNA检测值水平比较低。尽管这些患者没有进行针对性治疗,但后期肾功能有显著改善,这表明传统病理显示的low-grade TCMR可能是“对创伤的反应”,而不是排斥反应。无创ddcfDNA检测有利于对TCMR患者进行分级分类。
Sixth Research:ddcfDNA能否与基因表达谱检测组合运用以诊断MVI的发生?
ABMR主要病理表现为微血管炎症(Microvascular Inflammation, MVI),威斯康星大学麦迪逊分校的S. Parajuli教授团队希望通过同时使用ddcfDNA(Allosure,AS)和基因表达谱检测(Allomap kidney,AMK)来诊断MVI的发生。通过对All-MAP研究(NCT04057742)中DSA阳性肾移植患者进行前瞻性研究,分析了AS + AMK的综合评分(composite score)在诊断MVI>1时的特征。研究共入组了27个肾穿刺组织样本(26例患者),DSA I类MFI值为543±1497,II类MFI值为16374±14337。使用MVI =-9.1444+2.3122 * AS+0.5462 * AMK 公式可以区分MVI 0、MVI 1、MVI 2及以上样本。AS、AMK和AS + AMK综合评分的中位值分别为0.76、11.7和-0.3616 。AS + AMK综合评分在诊断MVI> 1时的AUC为0.87,具有很高准确性。当cut off值为-0.3981时,敏感性达到0.92,特异性达到0.73,PPV为0.73,NPV为0.92。当cut off值升高至0.82时,敏感性为0.58,NPV为0.75,特异性和PPV为100%;当cut off值降至-3.17时,敏感性和NPV分别为100%、特异性27%和PPV 52%(图7)。
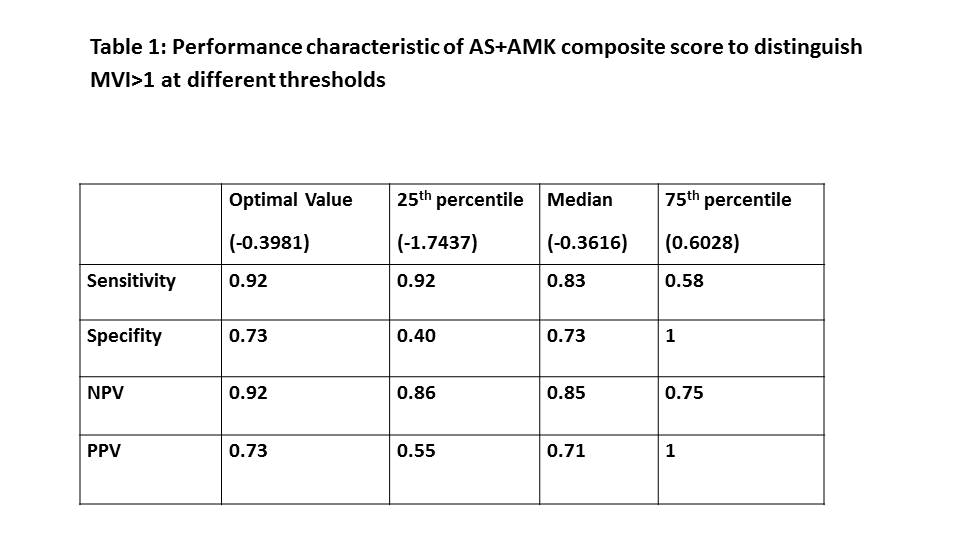 (图7)
(图7)
总 结
ddcfDNA检测值与Banff中排斥类损伤指标有较好的线性关系,可以诊断微血管炎症的发生;
对C4d阴性的ABMR也有很好的诊断价值,并且对ABMR的治疗有疗效评估作用;
提示ddcfDNA可以作为BL-TCMR风险分类的生物标志物,有利于临床对BL-TCMR的精准治疗。
【参考资料】
Aubert O,et al.Development and Validation of an Integrative DD-CFDNA System to Predict Allograft Rejection: A Population Based Study [abstract] . Am J Transplant. 2022; 22 (suppl 3).https://atcmeetingabstracts.com/abstract/development-and-validation-of-an-integrative-dd-cfdna-system-to-predict-allograft-rejection-a-population-based-study/.
Rizvi A,et al.Antibody-Mediated Kidney Allograft Rejection (ABMR) Monitoring and Intervention Based on ABMR Subtypes – A Step Towards Precision Diagnosis and Management[abstract]. Am J Transplant. 2022; 22 (suppl 3).https://atcmeetingabstracts.com/abstract/antibody-mediated-kidney-allograft-rejection-abmr-monitoring-and-intervention-based-on-abmr-subtypes-a-step-towards-precision-diagnosis-and-management/
Halloran PF,et al.Histologic Borderline Reflects Molecular Injury Not Rejection: Results from the Trifecta Study[abstract]. Am J Transplant. 2022; 22 (suppl 3).https://atcmeetingabstracts.com/abstract/histologic-borderline-reflects-molecular-injury-not-rejection-results-from-the-trifecta-study/.
Ellis MJ,et al.Wide Spectrum of Molecular Injury Highlights Heterogeneity of Banff Tubulitis and Interstitial Inflammation Lesions[abstract]. Am J Transplant. 2022; 22 (suppl 3).https://atcmeetingabstracts.com/abstract/wide-spectrum-of-molecular-injury-highlights-heterogeneity-of-banff-tubulitis-and-interstitial-inflammation-lesions/.
Kumar D,et al.Correlation of Donor-Derived Cell-Free DNA with Histology and Molecular Diagnoses of T-cell Mediated Rejection in Kidney Transplant Biopsies[abstract]. Am J Transplant. 2022; 22 (suppl 3).https://atcmeetingabstracts.com/abstract/correlation-of-donor-derived-cell-free-dna-with-histology-and-molecular-diagnoses-of-t-cell-mediated-rejection-in-kidney-transplant-biopsies/.
Parajuli S,et al.A Novel Approach to Non-Invasive Multimodality Testing with Allosure and Allomap Predicts Microvascular Inflammation with High Accuracy in Kidney Transplant Recipients [abstract]. Am J Transplant. 2022; 22 (suppl 3).https://atcmeetingabstracts.com/abstract/a-novel-approach-to-non-invasive-multimodality-testing-with-allosure-and-allomap-predicts-microvascular-inflammation-with-high-accuracy-in-kidney-transplant-recipients/.